A finales del siglo XIX,
Von Behring observó que los sueros de animales que habían padecido difteria
contenían sustancias que neutralizaban el efecto de la toxina diftérica. A
estas sustancias, que se caracterizaban por ser termolábiles y no dializables,
se les denominó anticuerpos, debido a su capacidad de reconcer a las toxinas
bacterianas.
En 1937 Tiselius descubre la electroforesis y aplica este nuevo método al fraccionamiento de proteínas
plasmáticas, identificando así los anticuerpos como las proteínas del suero que
se desplazan más lentamente. Esta fracción recibió el nombre
de g-globulina,
quedando así asociados temporalmente, los conceptos de anticuerpo y de g-globulina, como .Posteriormente,
se comprueba que notodos los anticuerpos migran
electroforéticamente con las g-globulinas, sino que muchos de ellos lo hacen
con las a y b globulinas. Esto se observó analizando los niveles de las
distintas fracciones de globulinas antes y después de la inmunización de
animales con un antígeno. Se
concluye entonces, que no todos los anticuerpos son gammaglobulinas, por lo que
Hebermans propone el término de inmunoglobulinas
para designar a todas las sustancias
con capacidad de anticuerpo. Hoy se conocen cinco tipos de inmunoglobulinas:
IgM, IgA, IgG, IgD e IgE, cada una de ellas con ciertas características
distintas.
Los cinco tipos de anticuerpos son los siguientes:
- Inmunoglobulina A (IgA),
presente en grandes concentraciones en las membranas mucosas,
particularmente en las paredes internas de las vías respiratorias y el
tracto gastrointestinal, como también en la saliva y las lágrimas.
- Inmunoglobulina G (IgG),
el tipo de anticuerpo más abundante en los líquidos corporales. Brinda
protección contra las bacterias y las infecciones virales.
- Inmunoglobulina M (IgM),
se encuentra principalmente en la sangre y en el líquido linfático. Es el
primer anticuerpo que el cuerpo genera para combatir una infección.
- Inmunoglobulina E (IgE),
se la asocia principalmente con las reacciones alérgicas (lo que ocurre
cuando el sistema inmunológico reacciona de manera exagerada a los
antígenos del medio ambiente, como el polen o el polvillo de los
animales). Se encuentra en los pulmones, la piel y las membranas mucosas.
- Inmunoglobulina D (IgD),
existe en pequeñas cantidades en la sangre y es el anticuerpo del que
menos conocimiento se tiene.
Por lo general tanto la IgA como la IgG y la IgM se miden
simultáneamente. Al evaluarse juntas, le brindan al médico información
importante sobre el funcionamiento del sistema inmunológico, especialmente en
lo relacionado con las infecciones y las enfermedades autoinmunes.
Estas cuatro cadenas estan
ligadas por enlaces disulfuro entre residuos de cisteinas que forman parte de
las cadenas peptidicas. Cada cadena L esta enlazada por este tipo de enlaces
a una cadena H y cada cadena H está ligada por ellos a una cadena L y a
la otra cadena H.
El siguiente grafico muestra a
las cadenas H en azul, a las cadenas L en verde y a los enlaces disulfuro entre
las cadenas como lineas rojas (no se representan en el grafico otros enlaces
disulfuro intracatenarios)
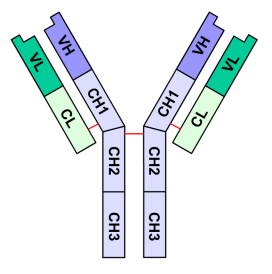
Observe tambien en el grafico
que pueden distinguirse dos regiones o dominios diferentes en las cadenas L: VL
y CL, mientras en las cadenas H pueden encontrarse 4 regiones: VH, CH1,
CH2 y CH3. Cada una de esas regiones esta compuesta por 70 a 110 aminoacidos.
Las regiones o dominios V se
denominan Variables: la secuencia de aminoácidos en esas regiones (las
porciones amino terminales de las cadenas L y H) es altamente variable, y
dentro de ellas, tanto en la cadena L como en la H, hay regiones
hipervariables, los CDRs o regiones determinantes de complementariedad
(Complementarity-determining regions) que forman los sitios de enlace con
el antígeno que son complementarios a la topología del antígeno especifico.
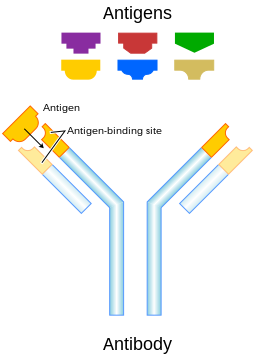
Como pueden observer, hay dos
sitios de enlace para antigenos en cada unidad (LH)2 . Cuando
una unidad (LH)2 es hidrolizada con papaina, se liberan
tres fragmentos: dos denominados Fab y uno llamado Fc.
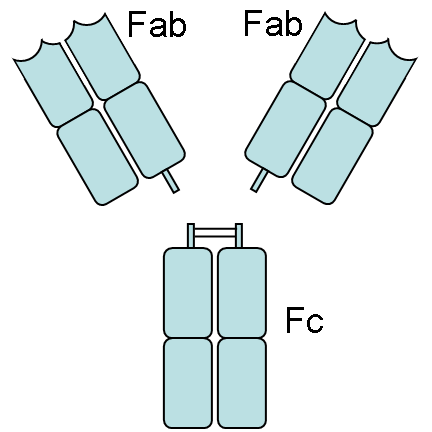
Los fragmentos Fab contienen la
estructura que es capaz de enlazarse al antigeno (Fab = Fragment
antigen-binding), mientras el fragmento Fc (c significa cristalizable) no puede
unirse al antígeno, pero contiene un sitio (o sitios) que se enlaza(n) a
proteínas del complemento y que es expuesto cuando ocurre la interaccion
entre el anticuerpo y el antígeno. La unión antigeno:anticuerpo se realiza a
traves de interacciones no covalentes (fuerzas de van der waals, puentes de
hidrogeno, interacciones hidrofobicas) y produce cambios
conformacionales similares a los observados en el mecanismo de ajuste inducido
en la interacción enzima:substrato. Ese efecto alosterico expone, en las
regiones constantes de la cadena pesadas, sitios relacionados con la unión y
activación de proteínas del sistema del complemento.
El sistema del complemento está
formado por al menos 11 proteínas diferentes que son activadas secuencialmente
para asociarse a la membrana de la célula invasora y causar su lisis y
muerte.
tra function importante del
sistema del complemento es el de generar opsoninas, proteinas que
estimulan la fagocitosis de la celula o bacteria invasora por neutrofilos y
macrofagos.
Ademas de activar al sistema
del complemento, las regiones constantes de las cadenas pesadas definen la
habilidad de la estructura basica (LH)2 de asociarse a
otras unidades (LH)2 units y determinan la clase de
inmunoglobulina, asi como su capacidad de atravesar la placenta confiriendo
inmunizacion pasiva al feto.
Hay cuatro clases de cadenas
pesadas: gamma, alfa, delta, epsilon y mu.
Estas cadenas difieren en el
tipo de regiones constantes que cada una tiene; por ejemplo, las cadenas
gamma son similares en sus regiones constantes, pero estas son diferentes
a las regiones constantes de las otras clases de cadenas pesadas.
Las inmunoglobulinas que
contienen cadenas gamma se denominan IgG. Las moléculas de IgG
estan formadas por una unidad (LH)2 . Las
Inmunoglobulinas G son las inmunoglobulinas más abundantes en el suero (600-1800
mg/dL). Estas inmunoglobulinas promueven la fagocitosis en el plasma y activan
al sistema del complemento. Las IgG son el único tipo de anticuerpos que puede
cruzar la placenta.
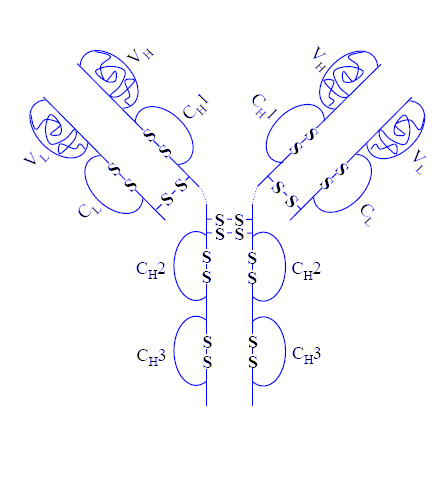
Observe en el siguiente
diagrama de una molécula de IgG las dos cadenas pesadas (en rojo y azul)
y las dos ligeras (en verde y amarillo)

En el diagrama que se muestra a
continuacion pueden observarse las regiones variables y constantes de la igG
asi como los enlaces disulfuro intercartenarios e intracatenarios presentes la
estructura (LH)2.
Las inmunoglobulinas que
contienen cadenas alfa se denominan IgA. Las IgA se encuentran
principalmente en las secreciones mucosas, en las lagrimas, el calostro y la
leche materna. Estas inmunoglobulinas son la defensa inicial de las mucosas
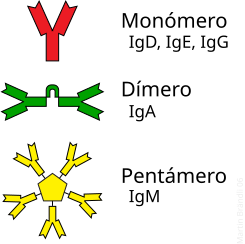
contra los agentes patógenos. Ellas aparecen usualmente como dímeros de
unidades (LH)2.
Las IgM contienen
cadenas pesadas mu. Los anticuerpos tipo IgM se expresan en la superficie de
los linfocitos B y se encuentran fundamentalmente en el plasma. Estos son los
primeros anticuerpos producidos en cantidades significativas contra un
antígeno. Las IgM promueven la fagocitosis y activan al sistema del
complemento. Aparecen usualmente como pentámeros de unidades (LH)2 con
sus cadenas pesadas unidas por un pequeño péptido.
Las Ig E contienen
cadenas pesadas tipo épsilon. La IgE, un monómero (LH)2 , juega
un importante papel en las reacciones alérgicas y posiblemente en la defensa
contra infestaciones por algunos parásitos intestinales, ya que se encuentra
aumentada en esas situaciones.
El papel fisiológico de
las IgD (inmunoglobulinas con cadena pesada) se desconoce. Reconoce a
los antígenos en los linfocitos B que no han sido expuestos. La estructura de
las IgD corresponde también a un monómero (LH)2 .
En base al tipo de regiones
constantes, las cadenas ligeras también se clasifican en dos subclases:
Lambda y Kappa. Cada molécula de inmunoglobulina contiene cadenas kappa o
cadenas lambda, pero no ambas.
En resumen, las
inmunoglobulinas son proteínas que actúan como anticuerpos. Ambos términos se
usan indistintamente: inmunoglobulinas para expresar estructura y anticuerpos
para expresar función. La estructura básica de las inmunoglobulinas es una
unidad formada por dos cadenas ligeras y dos cadenas pesadas. Estas unidades
contienen dominios variables y dominios constantes. Los dominios variables de
las cadenas L y H son responsables de la unión al antígeno, mientras que las
regiones constantes de las cadenas pesadas son responsables de la activación
del complemento y de la capacidad de algunas de estas unidades de formar
polímeros.
BIBLIOGRAFIA
http://temasdebioquimica.wordpress.com/2009/05/26/inmunoglobulinas-estructura-y-funcion/
No hay comentarios:
Publicar un comentario