Los seres vivos (SV) son organismos autónomos capaces de perpetuarse, de nutrirse y de relacionarse. Están formados por un conjunto limitado de moléculas basadas en el carbono que, esencialmente, son las mismas en todos las especies vivientes.
Las moléculas que forman los SV pueden clasificarse en:
. Inorgánicas: agua, sales minerales y algunos gases
. Orgánicas: glúcidos, lípidos, prótidos y ácidos nucleicos
Todas estas biomoléculas están organizadas en unas unidades superiores que son las células. Una célula es un recipiente, un recinto cerrado en cuyo interior se realizan las secuencias de reacciones químicas necesarias para la vida.
Una célula es un sistema capaz de mantener la concentración de algunas sustancias lo suficientemente alta como para que puedan producirse los procesos químicos que hacen posible que una célula realice todas sus funciones vitales. Por ello las células están rodeadas de membranas que retienen, o concentran de forma selectiva algunos compuestos químicos.
GLÚCIDOS
Son biomoléculas formadas por C, O e H. Desde el punto de vista químico son polialcoholes (varios grupos -OH) con un grupo carbonilo (=O) que puede ser terminal (aldehido) o no (cetona).
MONOSACÁRIDOS: Son los carbohidratos de molécula más sencilla, no pueden descomponerse en otros glúcidos más simples. Tienen entre 3 y 12 átomos de C.
Son sólidos, blancos, dulces, cristalinos y solubles en agua. En algunos de ellos , la molécula adopta una forma cíclica y se forman pentágonos o hexágonos (5ó6 átomos de C).
Monosacáridos principales:
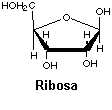
Ribosa y desoxirribosa. Son pentosas y forman parte del ARN y el ADN respectivamente.
Glucosa. Es una hexosa. Es la sustancia que emplean las células como fuente de energía. Forma parte de disacáridos y polisacáridos como el almidón. Es el azúcar más abundante en la naturaleza.
Fructosa. Es una hexosa. Está presente en muchas frutas. Forma parte de la sacarosa.
DISACÁRIDOS: Están formados por la unión de dos monosacáridos; cuando se produce esa unión se separa una molécula de agua. Son dulces, solubles en agua y cristalizables.
Disacáridos principales:
Sacarosa. Formada por un anillo de fructosa y otro de glucosa. Es el azúcar de la caña de azúcar o la remolacha.
Maltosa. Formada por la unión de dos anillos de glucosa. Aparece tras la hidrólisis del almidón o el glucógeno. Es el azúcar de la malta.
Lactosa. Es el azúcar de la leche de los mamíferos.
POLISACÁRIDOS: Están formados por la unión de muchos polisacáridos (entre 10 y miles). Tienen elevado peso molecular, no cristalizan, son insolubles en agua y no son dulces.
Polisacáridos principales:
Almidón. Formado por miles de anillos de glucosa. Es la sustancia que constituye la reserva energética de los vegetales y la principal fuente de glucosa para los animales. Tras las hidrólisis del almidón que ocurren el la digestión, se libera únicamente glucosa.
Glucógeno. Formado por unas 30.000 anillos de glucosa. Es la sustancia que fabrican los animales como reserva energética. Se encuentra en el hígado y los músculos.
Celulosa. Constituye la pared celular de las células vegetales. Tiene misión estructural. Es el componente principal de la madera y el algodón. Se calcula que el 50% de la materia orgánica de la biosfera es celulosa.
LÍPIDOS
Se trata de un grupo de sustancias que tienen en común el no ser solubles en agua, pero sí en disolventes orgánicos (benceno, acetona....), el tener un tacto untuoso y manchar el papel de forma característica. Químicamente es un grupo de sustancias muy heterogéneo: muchos de ellos tienen sólo C, O, e H, formando cadenas lineales o varios anillos aromáticos unidos entre sí; pueden contar con átomos de N, P y S.
Los lípidos son la base de las membranas celulares, pero funcionan también como almacenes de energía, cubiertas protectoras, hormonas, vitaminas, pigmentos fotosintéticos, aislantes térmicos...
ÁCIDOS GRASOS: Son ácidos orgánicos (tienen un grupo COOH) con un número par de átomos de C (entre 12 y 14). Si los enlaces son sencillos, se habla de ácidos grasos saturados, que son sólidos a temperatura ambiente y si hay algún doble enlace en la cadena, se denominan ácidos grasos insaturados, que son líquidos a temperatura ambiente y forman parte de los aceites vegetales.
Son moléculas muy energéticas. La oxidación completa de un ácido graso produce más calorías por gramo que la de cualquier compuesto orgánico.
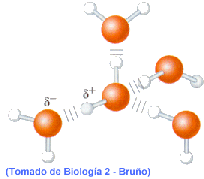
Estas moléculas tienen la particularidad de ser bipolares, es decir, una zona es iónica o polar y por lo tanto hidrófila, el otro extremo es apolar e hidrófobo. Por eso en disolución acuosa pueden formar películas superficiales o pequeñas esferas en las que la parte hidrófila toma contacto con el agua.
Ejemplos de ácidos grasos son el oleico, el palmítico, linoleico o el araquidónico.
LÍPIDOS SAPONIFICABLES: Formados por ácidos grasos unidos a otras moléculas. Cuando se hidrolizan dan lugar a ácidos grasos y alcoholes. En el laboratorio pueden reaccionar con álcalis (NaOH o KOH) para dar jabones y alcohol.
Los más importantes son los triglicéridos, los lípidos de membrana y las ceras.
Triglicéridos: Se encuentran formando grandes gotas en el interior de las células. En los animales se acumulan en el tejido adiposo y constituyen la reserva energética. El que está bajo la piel actúa como aislante térmico y sirve como amortiguador de golpes. En los vegetales son frecuentes en las semillas para proporcionar energía al embrión.
Lípidos de membrana: Son sustancias que forman la base de cualquier membrana celular. Sus moléculas se sitúan de modo que las zonas polares quedan en contacto con el agua y las zonas apolares fuera del contacto con el agua, con lo que dan lugar a una bicapa. Losfosfoglicéridos son los más abundantes en las membranas. Los esfingolípidos aparecen con más frecuencia en las células del tejido nervioso.
Ceras: Poseen los dos extremos de sus moléculas hidrófobos, por lo que son sustancias que desempeñan funciones de protección e impermeabilización.
LÍPIDOS NO SAPONIFICABLES: Su composición química es heterogénea; están presentes en pequeñas cantidades, pero se trata de moléculas muy activas.
A este grupo pertenecen estas sustancias:
. Colesterol: Forma parte de las membranas celulares de los animales y controla su permeabilidad a algunos nutrientes. Su exceso en el torrente sanguíneo provoca la aparición de placas de ateroma en las arterias que entorpecen o impiden la circulación.
. Ácidos biliares: Se encargan de emulsionar las grasas en la digestión para facilitar la tarea de los enzimas que hidrolizan las grasas. Son sintetizados por el hígado.
. Hormonas esteroideas: progesterona, testosterona, cortisol, cortisona, aldosterona....
. Vitamina D: Se encarga de regular la concentración de Ca y P.
A este grupo pertenecen también sustancias como el mentol, la vitamina E, la xantofila o el caucho.
Para facilitar el transporte de los lípidos por el organismo (son insolubles en agua) éstos se unen a proteínas y dan lugar a las lipoproteínas:Algunas lipoproteínas conocidas son:
LDL: Producidas por el hígado para repartir el colesterol a los tejidos. Su exceso (“colesterol malo”) favorece la formación de ateromas.
HDL: o “colesterol bueno” Transporta los restos de colesterol hasta el hígado para su degradación y excreción con la bilis.
PROTEÍNAS (P)
Son las sustancias que componen las estructuras celulares y las herramientas que hacen posible las reacciones químicas del metabolismo celular. En la mayoría de los seres vivos (a excepción de las plantas que tienen más celulosa) representan más de un 50% de su peso en seco. Una bacteria puede tener cerca de 1000 P diferentes, en una célula humana puede haber 10.000 clases de P distintas.
Químicamente son macromoléculas, polímeros de aminoácidos (más de 100) dispuestos en una secuencia lineal, sin ramificaciones. Una secuencia de menos de 100 aminoácidos se denomina péptido.
Los aminoácidos (aa) son moléculas orgánicas pequeñas con un grupo amino (NH2) y un grupo carboxilo (COOH). La gran cantidad de proteínas que se conocen están formadas únicamente por 20 aa diferentes. Se conocen otros 150 que no forman parte de las P. Los aa se unen entre sí mediante el llamado enlace peptídico (se produce entre el grupo amino de un aa y el carboxilo del siguiente, con desprendimiento de una molécula de agua).
NIVELES DE ESTRUCTURACIÓN DE LAS P
Estructura primaria: Viene definida por la secuencia de aa en la cadena.
Estructura secundaria: Es la disposición espacial de la cadena de aa. En función del tipo de aa, y de los enlaces que se establecen entre ellos, la cadena puede tomar una forma de helicoide o de lámina plegada (como un biombo).
Estructura terciaria: Se refiere al aspecto tridimensional global de la molécula y se debe a las interacciones de diversos tipos que se establecen entre los grupos laterales de los aminoácidos. Si la P mantiene su estructura de hélice o de lámina plegada, se habla de estructura terciaria fibrosa (el colágeno o la queratina la tienen) ; Si la cadena se pliega en una estructura tridimensional compacta más o menos esférica, se dice que tiene estructura terciaria globular. Esta estructura es la que confiere a la P su actividad biológica.
Estructura cuaternaria: Sólo está presente en P formadas por más de una cadena polipeptídica y hace referencia a la estructura espacial global de toda la P, consecuencia de las interacciones y la organización espacial de las diferentes subunidades.
PROPIEDADES DE LAS P
1.- Solubilidad: Las globulares son solubles en agua, pero debido a su elevado peso molecular forman dispersiones coloidales. Las fibrosas son insolubles en agua.
2.- Desnaturalización: Consiste en la pérdida de total o parcial de los niveles de organización superiores al primero. Si ocurre, pierden su actividad biológica. Depende de factores físicos como la temperatura, radiaciones, agitación, o químicos, como pH o disolventes orgánicos. El proceso puede ser irreversible (clara del huevo cocida) o no.
3.- Especificidad: Desde dos puntos de vista:
Las P homólogas de diferentes especies son semejantes, pero no idénticas, se encuentran diferencias incluso entre individuos de la misma especie.
Cada P realizan una función determinada y específica, que depende de su estructura. Son capaces de reconocer específicamente a una sustancia e interactuar con ella.
FUNCIONES DE LAS P
a) Ación enzimática: Los enzimas son P que catalizan casi todas las reacciones químicas que se producen en la célula; por eso se les denomina Biocatalizadores. Ejemplos: polimerasa, nucleasas, ligasas o endonucleasas, que intervienen en la formación de las cadenas de ADN y ARN.
b) Transporte: Ciertas P se unen a moléculas o iones en un lugar y los liberan en otro, Ej: Hemoglobina que transporta O2 y CO2 o laspermeasas de las membranas que trasladan de un lado al otro de la membrana determinadas sustancias.
c) Movimiento y contracción: Son P que intervienen en la contracción de las fibras musculares, como la miosina, otras forman cilios o flagelos.
d) P estructurales: Forman las estructuras de los orgánulos celulares. Pueden ser fibrosas como el colágeno, presente en el hueso y el tejido conectivo, o globulares, como las de las membranas celulares.
e) Nutrición y reserva: Las albúminas de la sangre o el huevo, la caseína de la leche o las de las semillas son una importante fuente de aminoácidos.
f) Inmunidad: La inmunoglobulinas son proteínas de defensa que identifican y neutralizan virus, bacterias o sustancias extrañas. Los interferones se ocupan de la defensa antiviral.
g) Regulación hormonal: Algunas hormonas como la paratiroidea o la insulina son P.
h) Regulación de la diferenciación: Existen P que inhiben o activan algunos genes, lo que puede dar lugar a la diferenciación celular o al inicio de procesos como la aparición de los caracteres sexuales secundarios con la llegada de la pubertad.
i) Percepción y transmisión de señales: Algunas P de membrana son receptores de hormonas y de otras sustancias.
ÁCIDOS NUCLEICOS
Una característica esencial de los seres vivos es su capacidad para reproducirse. Para ello cada individuo debe contener una descripción completa de sí mismo, que además ha de ser capaz de transmitir a sus descendientes para que ellos puedan construir otro individuo con esas características. A nivel celular, una célula ha de disponer de esas instrucciones para construir una réplica idéntica de sí misma. En una célula, esa información se encuentra en el ácido desoxirribonucleico (ADN). El ADN tiene la particularidad de que posee información también para hacer copias de sí mismo. Para que la información contenida en el ADN se pueda expresar hace falta otra sustancia que es el ácido ribonucleico (ARN).
Los ácidos nucleicos (AN) son las mayores moléculas que existen en la tierra: pueden medir hasta 0,1 m de longitud.
COMPONENTES DE LOS ÁCIDOS NUCLEICOS: Como todas las macromoléculas los AN están formados por la unión de unas unidades, que son los nucleótidos.
Cada nucleótido está formado por:
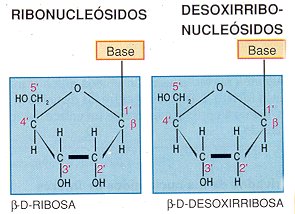
Un azúcar, que es una pentosa: ribosa para el ARN y desoxirribosa para el ADN
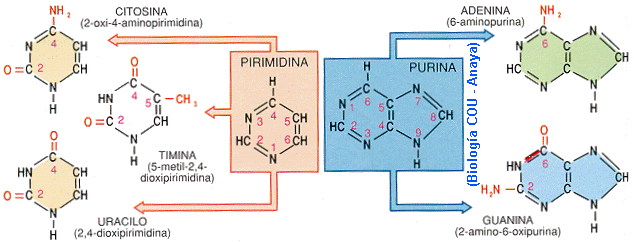
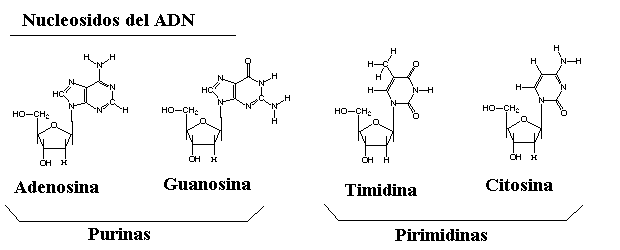
Una base nitrogenada (compuestos cíclicos con N). Pueden ser purinas: adenina (A) y guanina (G) o pirimidinas: citosina (C), timina (T) y uracilo (U)
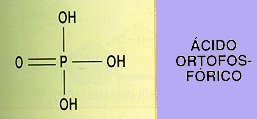
Un grupo fosfato (del ácido ortofosfórico).
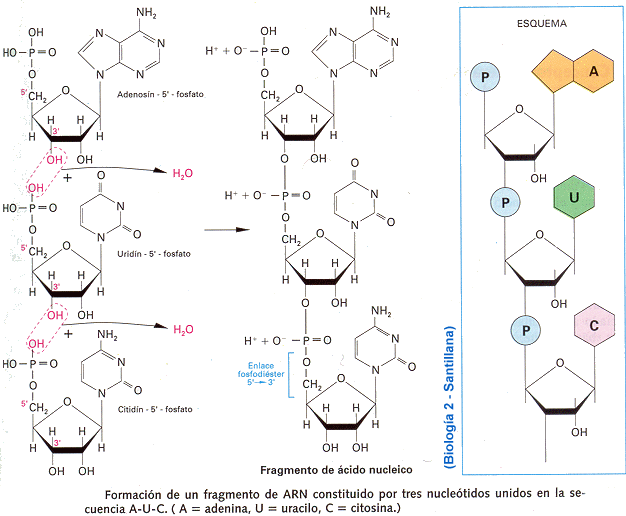
Una base se une a una pentosa y forma un nucleósido. Este enlace se llama B-glucosídico y se realiza entre el carbono 1 de la pentosa y el nitrógeno 9 de las bases púricas o el N1 de las pirimidínicas; cuando se produce se libera una molécula de agua.
Los nucleótidos se forman por la unión de un nucleósido con el ácido ortofosfórico, que se une mediante un enlace éster al azúcar. La presencia de este fosfato les da carácter ácido.
Los nucleótidos se unen entre sí mediante enlaces fosfodiéster entre el grupo 3-hidroxilo de un nucleótido y el grupo 5-hidroxilo del siguiente.
Los AN están formados por cadenas de nucleótidos. El esqueleto de estas moléculas lo constituyen grupos alternantes de fosfato y pentosa; las bases nitrogenadas forman cadenas laterales.
ARN: Se encuentra en el citoplasma y en el núcleo de la célula. Su función está relacionada con la síntesis de proteínas. Está formado por una cadena de ribonucleótidos; el azúcar es la ribosa, y las bases son: adenina, guanina, citosina y uracilo. La única diferencia que existe entre nucleótidos reside en la presencia de una base u otra.
. El orden de los nucleótidos en la molécula de ARN se llama secuencia y constituye la estructura primaria del ARN.
. Las bases pueden formar puentes de hidrógeno entre sí, preferentemente adenina con uracilo y citosina con timina. Esto da lugar a la estructura secundaria del ARN.
. Esta estructura puede plegarse en el espacio y conseguir una configuración tridimensional estable: es la estructura terciaria de la molécula.
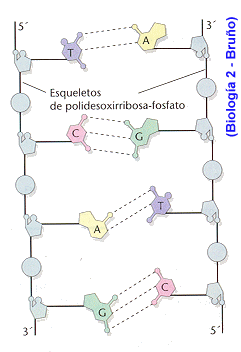
ADN: Se encuentra en el núcleo de la célula. Su misión es constituir el material genético. Está formado por dos cadenas de desoxinucleótidos enrolladas una sobre otra; el azúcar es la desoxirribosa y las bases: adenina, timina, citosina y guanina.
. El enrollamiento tiene forma de doble hélice.
. Las bases están dirigidas hacia el interior de la doble hélice.
. Las dos cadenas se mantienen unidas por puentes de H entre bases complementarias: A con T y C con G.
Para codificar toda la información que requiere el desarrollo de un ser vivo, se necesitan moléculas de ADN muy largas, lo que plantea un problema para el volumen del núcleo de la célula. El ADN se encuentra asociado a unas proteínas que favorecen su empaquetamiento a distintos niveles. Al complejo formado por el ADN y estas proteínas se le denomina cromatina. En los momentos previos a la división celular, el material nuclear sufre otros empaquetamientos, aún no muy bien conocidos, hasta alcanzar la estructura de los cromosomas metafásicos, lo que puede suponer una disminución de tamaño de 50.000 veces respecto de la longitud inicial.